Descripción
Antelmann y colaboradores acuñaron el término de “secretoma”, y se define como un subgrupo del proteoma que activamente se secreta fuera de la célula, por lo cual, obtiene su nombre. El secretoma de las células y de los tejidos puede reflejar una amplia variedad de condiciones patológicas y representa una fuente muy rica para la búsqueda de biomarcadores. Las proteínas secretadas, se aísla generalmente de sobrenadantes de cultivos celulares o de fluidos corporales, haciendo difícil su identificación y análisis, porque estas proteínas se enmascaran a menudo con otras de altas concentraciones (Greenbaum, Luscombe, Jansen, Qian, & Gerstein, 2001; Zwickl et al., 2005).
Material y equipos
- Botellas de cultivo de ≥500 cm2
- Medio de cultivo con y sin Rojo Fenol
- Micropipetas y pipetas para cultivo
- Antibiotico-Antimicotico
- Incubadora con inyección de CO2
- Centrifugaas
- Membranas de PVDF 0.22 µm
- Liofilizador
- Congelador o Ultracongelador
Reactivos
- Nitrógeno líquido
- Acetona
- Disolución fisiológica
- Sacarosa
- Tris-Base
- KCl
- HCl
- EDTA
- 2-Mercaptoetanol
- PVPP
- Urea
- Tiourea
- CHAPS
- TBP
- Anfolinas
- DTT
- Acetato de amonio
- Metanol
- Bradford
Procedimiento
- Las líneas celulares se cultivan con medio Advanced-RPMI 1640 suplementado con antibióticos (Anti-anti, Gibco) y sin suero fetal bovino (SFB) a una temperatura de 37°C, 5% de CO2 y un ambiente saturado de humedad.
- Para obtener los sobrenadantes, las líneas celulares se deben crecer hasta el 70% de confluencia en botellas de cultivo (recomendado 500 cm2)
- Se lavan con abundantemente con disolución fisiológica (~800 mL) y se incuban por 20 h con medio fresco RPMI-1640 sin rojo fenol y sin SFB.
- El sobrenadante se colecta y se centrifuga a 4,500 g por 5 min y posteriormente se filtra con una membrana de PVDF (0.22 µm) para eliminar cualquier célula en suspensión.
- Las muestras se congelan en nitrógeno líquido y se liofilizan durante 48 horas o hasta que estén completamente deshidratadas
- Posteriormente se resuspende la muestra en un volumen entre 1-10 mL y se precipitan las proteínas con acetona fría al 90% por ≥2h a -20°C
- Se centrifuga a 5,000 g por 20 min, el botón se resuspende en un vortex
- Se agregan 5mL de buffer de extracción (ver abajo: Tabla 1)
- Se agrega un volumen igual de fenol para separar las proteínas y se agita durante 20 min
- Se centrifuga a 7,000 g por 10 min, y se recupera la parte orgánica
- Posteriormente se precipita con 5 volúmenes de acetato de amonio 0.1M en metanol por ≥2 h a -80°C.
- Después se centrifuga y se obtiene un botón que será lavado 2-3 veces con 2 mL de acetona fría al 90% y un lavado con 500µL acetona fría absoluta.
- Se evapora la acetona con una centrifuga de vacio sin llevar sequedad la muestra
- Se agregan entre 50-100 µL de buffer de solubulización (ver abajo: Tabla 2). NOTA: se puede emplear buffer Leammli para ensayos de 1D o este buffer para 2D-PAGE
- Se procede a determinar la concentración proteica mediante el método de Bradford.
Tabla 1. Buffer de extracción
Concentración Final Reactivo para 200mL 0.7 M Sacarosa 47.922 g 0.5 M Tris-Base 12.11 g 0.1 M KCl 1.4 g 30 mM HCl 0.48 mL 50 mM EDTA (292.24 g/mol) 2.9224 g 2% v/v 2-Mercaptoetanol 4 mL 1.2% p/v PVPP 2.4 g Tabla 2. Buffer de solubilización de proteínas
Concentración Final Reactivo Para 5ml 7 M Urea 2.1033 g 2 M Tiourea 0.761 g 4% CHAPS 0.2 g 2 mM TBP 0.05 mL 2% Anfolinas 3-10pH 0.1 mL 60 mM DTT 0.04627 g Resultados
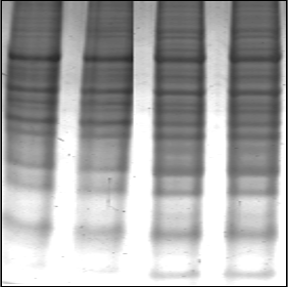
Cómo citar: Checa Rojas, A. (2017, 04 de Diciembre ) Método: Secretoma de líneas celulares. Conogasi, Conocimiento para la vida. Fecha de consulta: Septiembre 4, 2025
Esta obra está disponible bajo una licencia de Creative Commons Reconocimiento-No Comercial Compartir Igual 4.0





Deja un comentario
Sé el primero en comentar!